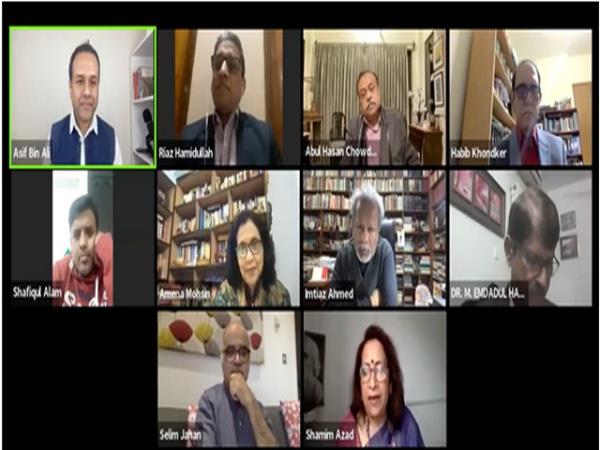
图1:模拟酶c-Src激酶(绿色)与抑制剂PP1(品红、蓝、白球体)在低co(左)和高co(右)存在下的相互作用牛血清白蛋白(BSA;灰色)。模拟结果表明,牛血清白蛋白的聚集降低了PP1与c-Src激酶结合的能力。©laguna设计/科学图片库
图1:模拟酶c-Src激酶(绿色)与抑制剂PP1(品红、蓝、白球体)在低co(左)和高co(右)存在下的相互作用牛血清白蛋白(BSA;灰色)。模拟结果表明,牛血清白蛋白的聚集降低了PP1与c-Src激酶结合的能力。©laguna设计/科学图片库
日本理研所研究人员的超级计算机模拟揭示了,随着周围环境中其他蛋白质的混杂,药物与蛋白质靶点的结合是如何发生变化的。这些模拟可以帮助改善药物开发,因为它们阐明了为什么一些药物在理论上有效,但在实践中失败。
药物开发的初始阶段通常包括模拟分子与其靶蛋白之间的相互作用。虽然这些模拟可以表明药物是有效的,但当在活细胞上进行测试时,这种相互作用往往无法达到预期效果。日本理研生物系统动力学研究中心(BDR)的计算生物物理学家Yuji Sugita和他的同事们希望通过计算细胞通常拥挤的环境,使模拟更加精确。
Sugita解释说:“细胞内存在许多蛋白质和大分子,使其成为一个拥挤的环境。”“事实上,大分子占细胞质体积的四分之一到一半。我们想要发现这些拥挤的环境是如何影响药物与目标蛋白的结合的。”
为此,他们开发了一种高度优化的软件程序,名为GENESIS,用于日本的超级计算机。然后,他们在不同浓度的牛血清白蛋白(BSA)存在下进行了微秒级的酶(c-Src激酶)与抑制剂(PP1)相互作用的模拟。杉田的合作者、密歇根州立大学(Michigan State University)教授迈克尔·费格(Michael Feig)也在美国用分子动力学超级计算机对同样的系统进行了模拟。该团队选择c-Src激酶是因为这种酶调节信号转导通路,其失调与包括癌症在内的许多疾病有关。
研究人员发现,牛血清白蛋白的聚集通过物理阻断PP1的途径,以及与它微弱的、非特异性的相互作用,减少了PP1能够到达酶的数量。
尽管如此,还是有少量的PP1能够从人群中穿过。但模拟结果显示,牛血清白蛋白聚集也覆盖了c-Src激酶上的一些结合位点,并改变了酶的形状,改变了其到达主要结合位点的途径。
该团队通过在类似条件下使用实际蛋白质进行实验室测试来验证他们的结果。这些由Mikako Shirouzu和她的同事在日本理研所进行的实验表明,PP1抑制c-Src激酶的功效随着BSA拥挤程度的增加而降低。
该团队现在想要研究拥挤如何影响其他靶蛋白和药物。他们还打算利用超级计算机研究生物膜和细胞器内的蛋白质功能。Sugita说:“这些不同的环境可能会以相似或不同的方式影响蛋白质的功能。”“我们只是不知道。”